pH
ค่า pH (อังกฤษ: pH ย่อมาจาก Potential of Hydrogen ion) เป็นค่าที่แสดงความเป็นกรดเป็นเบสของสารเคมีจากปฏิกิริยาของไฮโดรเจนไอออน (H+) สามารถทดสอบได้หลายวิธี โดยวิธีที่นิยมและง่ายสุดคือทดสอบด้วยกระดาษลิตมัสจากการเปลี่ยนสี
สำหรับตัวเลขที่แสดงค่า pH ถ้าพิจารณาอย่างง่ายที่อุณหภูมิห้อง ค่าเท่ากับ 7 แสดงว่าสารนั้นเป็นกลางไม่มีฤทธิ์เป็นกรดหรือเบส เช่น น้ำบริสุทธิ์ ถ้ามีค่าน้อยกว่า 7 แสดงว่าเป็นกรด และถ้ามากกว่า 7 แสดงว่าเป็นเบส
ตัวอย่าง ค่าพีเอชของสารต่าง ๆ
| สาร | pH |
|---|---|
| กรดสารพิษจากเหมืองร้าง | |
| กรดจากแบตเตอรี | |
| กรดในกระเพาะอาหาร | |
| เลมอน | |
| Coke | |
| น้ำส้มสายชู | |
| ส้ม หรือ แอปเปิล | |
| เบียร์ | |
| ฝนกรด | |
| กาแฟ | |
| ชา | |
| นม | |
| น้ำบริสุทธิ์ | |
| น้ำลายมนุษย์ | |
| เลือด | |
| น้ำทะเล | |
| สบู่ล้างมือ | |
| แอมโมเนีย (ยาสามัญประจำบ้าน) | |
| น้ำยาปรับผ้านุ่ม | |
| โซดาไฟ |
การ วัดค่า pH
หลักการเบื้องต้นของ pH Measurement หลักการเบื้องต้นจะใช้วิธีในการวัดค่าความต่างศักย์ไฟฟ้าของไอออนในสารละลาย ระหว่าง Glass Electrode เปรียบเทียบกับ Reference Electrode ซึ่งเป็นเซลล์มาตรฐานที่ทราบค่าศักย์ไฟฟ้าแล้ว
Glass Electrode ประกอบด้วยส่วนรับรู้ค่า pH Glass Membrane ซึ่งปกติจะเป็นลักษณะรูปทรงกลม, Insulating Glass Stem เมื่อ Electrode จุ่มลงสารประกอบไอออนของ ไฮโดรเจนจะมาอยู่ตามบริเวณ Membrane Surface ซึ่งจะทำให้เกิดศักย์ไฟฟ้า โดยศักย์ไฟฟ้าที่ Electrode Glass ตรวจวัดได้สามารถที่จะคำนวณค่าได้จากสมการ
- เมื่อ
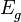 = ผลรวมของค่าความต่างศักย์ไฟฟ้าที่ได้จากการวัด
= ผลรวมของค่าความต่างศักย์ไฟฟ้าที่ได้จากการวัด = ค่าความต่างศักย์ไฟฟ้าเมื่อค่า
= ค่าความต่างศักย์ไฟฟ้าเมื่อค่า  = 1
= 1 = ผลรวม ไอออนของไฮโดรเจน
= ผลรวม ไอออนของไฮโดรเจน = ค่าอุณหภูมิสัมบูรณ์เป็นองศาเคลวิน
= ค่าอุณหภูมิสัมบูรณ์เป็นองศาเคลวิน = 1.986 Calories ต่อ mol degree
= 1.986 Calories ต่อ mol degree = Faraday (coulombs per mol)
= Faraday (coulombs per mol)
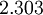 = logarithm conversion factor
= logarithm conversion factor
ค่า pH จะได้มาจากค่าลบ logarithm ของผลรวมไอออนไฮโดรเจน
จากสมการด้านบน จะพบว่าค่าไอออนที่ตรวจจับได้ที่ Membrane จะเป็นค่าที่กำหนดค่าความต่างศักย์ไฟฟ้าที่เกิดขึ้น ซึ่งถ้าที่ Membrane สกปรกจะทำให้ค่า pH ที่วัดได้มีค่าผิดพลาดตามไปด้วย
จากสมการ จะเห็นได้ว่า ศักย์ไฟฟ้าจะขึ้นกับอัตราส่วนความเข้มข้นของ แล้วยังขึ้นอยู่กับอุณหภูมิ (T) อีกด้วยดังนั้นการวัด pH ที่ถูกต้องจำเป็นต้องมีการปรับเทียบเครื่องวัดไปที่อุณหภูมิที่ถูกต้องหรือ คือจำเป็นต้องตรวจวัดอุณหภูมิของสารละลาย เพื่อทำการปรับภายในวงจรอีกทีหนึ่ง เครื่องวัด pH ที่สมบูรณ์นอกจากจะมีขั้วปรับเทียบแล้วยังมีตัวตรวจวัดอุณหภูมิของสารละลาย ละลายติดอยู่ด้วย
Reference Electrode จะมีค่าความต่างศักย์ไฟฟ้าที่คงที่โดยไม่ขึ้นกับอุปกรณ์ตัวใด จากรูปโครงสร้างของ Reference type จะประกอบด้วย Mercury (ปรอท) ซึ่งจะสัมผัสอยู่กับ Mercurous chloride (HG2Cl2 ) และ Potassium chloride (KCl ) เมื่อคิดค่าความต่างศักย์ไฟฟ้าที่ Reference Electrode รวมกับค่าความต่างศักย์ไฟฟ้าสามารถหาค่า ได้ตามสมการ
- เมื่อ
 = ความต่างศักย์ไฟฟ้าที่ Reference Electrode
= ความต่างศักย์ไฟฟ้าที่ Reference Electrode = ความต่างศักย์ไฟฟ้าที่ Liquid Junction
= ความต่างศักย์ไฟฟ้าที่ Liquid Junction
Thermo Compensating Resistorจะทำหน้าที่ชดเชยอุณหภูมิที่เปลี่ยน แปลงไป เพื่อให้ผลการวัดได้ถูกต้องโดยไม่ขึ้นกับอุณหภูมิวงจรที่ใช้งานร่วมกับ Thermo Compensating Resistor จะออกแบบให้หักล้างกับค่าแรงดันไฟฟ้าที่เกิดจากการเปลี่ยนแปลงอุณหภูมิของ สารละลายที่ทำการวัดโดยสมการวงจรชดเชยจะได้ดังนี้




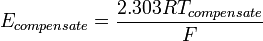
ไม่มีความคิดเห็น:
แสดงความคิดเห็น